可逆反应:2NO2 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO
②单位时间内生成nmolO2的同时生成2nmolNO2
③用NO2,NO,O2表示的反应速率的比为2∶2∶1的状态
④混合气体的压强不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
⑦混合气体的颜色不再改变的状态
| A.②④⑥⑦ | B.②③⑤⑦ |
| C.①③④⑤ | D.全部 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol·L—1的甲酸溶液的c(H+)约为O.01 mol·L—1 |
| B.甲酸与水能以任意比互溶 |
| C.10 mL 1 mol·L—1甲酸恰好与10 mL 1 mol·L—1 NaOH溶液完全反应。 |
| D.甲酸溶液的导电性比一元强酸溶液的弱 |
下列物质的水溶液能导电,但属于非电解质的是()
| A.CH3COOH | B.Cl2 | C.NH4HCO3 | D.SO3 |
下图表示可逆反应mA(g)+nB(g)  pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是()
pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是()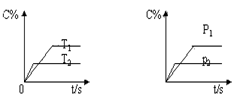
A.吸热反应,m+n<p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.放热反应,m+n>p
COCl2(g) CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO的浓度;④减压;⑤加催化剂;⑥恒压时通入惰性气体,能提高COCl2转化率的是()
CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO的浓度;④减压;⑤加催化剂;⑥恒压时通入惰性气体,能提高COCl2转化率的是()
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
设C+CO2 2CO1△H = Q1kJ·mol-1反应速度为v1,
2CO1△H = Q1kJ·mol-1反应速度为v1,
N2+3H2 2NH3△H = -Q2kJ·mol-1反应速度为v2,对于上述反应,
2NH3△H = -Q2kJ·mol-1反应速度为v2,对于上述反应,
当温度升高时v1和v2的变化情况为:(Q1、Q2均为正值)()
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |