下列事实中不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅 HBr+HBrO,当加入NaOH溶液后颜色变浅 |
B.对2NO2(g)  N2O4(g) 平衡体系,增加压强使颜色变浅 N2O4(g) 平衡体系,增加压强使颜色变浅 |
C.反应CO+NO2 CO2+NO △H < 0升高温度使平衡向逆方向移动 CO2+NO △H < 0升高温度使平衡向逆方向移动 |
| D.向双氧水溶液中滴入FeCl3溶液后,产生气泡速率加快 |
下列离子方程式不正确的是( )
| A.碳酸钠溶液和盐酸反应 Na2CO3+2H+  2Na++CO2↑+H2O 2Na++CO2↑+H2O |
| B.过氧化钠和水反应 2Na2O2+2H2O  4Na++4OH-+O2↑ 4Na++4OH-+O2↑ |
| C.钠跟水反应 Na+H2O  Na++OH-+H2↑ Na++OH-+H2↑ |
| D.碳酸氢钠溶液跟稀硝酸反应 |
HCO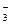 +H+
+H+ CO2↑+H2O
CO2↑+H2O
称量烧碱时,不将它放在纸上,而是放置在烧杯等玻璃器皿中,主要是因为( )
| A.放在纸上称量不如放置在烧杯中称量精确 |
| B.配制溶液总是在烧杯中进行的,直接在烧杯中进行称量的目的是为了减少操作步骤 |
| C.烧碱易潮解,且腐蚀性强 |
| D.纸上称量易沾上杂质,降低所配溶液纯度 |
下列不属于碱金属单质的通性的是( )
| A.硬度小、密度小、熔点低 |
| B.导热、导电性能强 |
| C.焰色反应的颜色相近 |
| D.强还原性 |
下列灭火剂能用于扑灭金属钠着火的是()
| A.干冰灭火剂 |
| B.黄沙 |
| C.干粉(含NaHCO3)灭火剂 |
| D.泡沫灭火剂 |
钠元素是人体必需的宏量元素之一,其作用是与HCO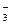 一起调节体液pH,与K+一起对骨骼肌起兴奋作用。成年人每天摄入食盐多于26 g者,高血压发病率可达39%,每天摄入食盐少于5 g,又会导致骨骼软化、恶心、厌食、嗜睡等低盐综合症,研究表明成人每天食盐摄入量以5~8 g为宜。按此标准计算,成年人每人每天摄入Na+不应该高于()
一起调节体液pH,与K+一起对骨骼肌起兴奋作用。成年人每天摄入食盐多于26 g者,高血压发病率可达39%,每天摄入食盐少于5 g,又会导致骨骼软化、恶心、厌食、嗜睡等低盐综合症,研究表明成人每天食盐摄入量以5~8 g为宜。按此标准计算,成年人每人每天摄入Na+不应该高于()
| A.4.85 g | B.1.97 g |
| C.3.03 g | D.3.15 g |