已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol 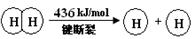
下列说法不正确的是
| A.该反应原理可用于设计氢氧燃料电池 |
| B.破坏1 mol H—O 键需要的能量是463.4 kJ |
| C.H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ/mol |
| D.H2(g) 中的H—H 键比 H2O(g) 中的H—O 键牢固 |
几种难溶物质的有关数值如表所示:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-36 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
≥3 |
下列关于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法正确的是
A、向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀
B、该溶液中c(SO ):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C、当pH=10时,溶液中c(Fe2+):c(Fe3+)=2×1020:1
D、向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物;
常温下,用0.1000 0 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/L CH3COOH溶液所得滴定曲线如图。下列说法不正确的是
| A.a点所示溶液中: c(Na+)=c(CH3COOH)+c(CH3COO-) |
| B.b和c点所示溶液中:C(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| C.d点所示溶液中:C(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.滴定过程中可能出现:C(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
用铂电极电解NaCl和CuSO4的混合溶液,当电路中通过4mol电子时,阴极和阳极上都产生1.4mol气体,电解后溶液体积为4L。则最后电解液的pH接近
| A.1 | B.2 | C.13 | D.14 |
下列说法正确的是
A.按系统命名法,化合物 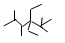 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
| B.等质量的乙烯和2-甲基-2-丁烯完全燃烧消耗氧气的量不相等 |
| C.分子式为C10H20的烯烃分子中的10个C原子可能在一个平面上 |
| D.分子式为C8H18的分子中的所有C原子可能都在一个平面上 |
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br—,然后Br+首先与CH2=CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是


| A.ClCH2CH2Cl | B.BrCH2CH2Br | C.BrCH2CH2I | D.BrCH2CH2Cl |