实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g 样品,溶于水配成250 .00 ml溶液,取出该溶液25.00 ml用 0.1 mol·L-1盐酸进行滴定,得到如下曲线。以下说法或操作正确的是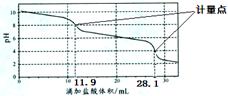
| A.上一个计量点前发生反应的离子方程式为HCO3-+H+===H2O+CO2↑ |
| B.下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C.此样品n(NaHCO3)=" (28.1" - 2×11.9)×10-4 mol |
| D.使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
某反应由两步反应A→B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。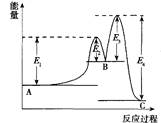
下列有关叙述正确的是
| A.两步反应均为吸热反应 |
| B.加入催化剂会改变反应的焓变 |
| C.三种化合物中C最稳定 |
| D.A→C反应中ΔH = E1 - E2 |
将左下图中所示实验装置的K闭合,下列判断正确的是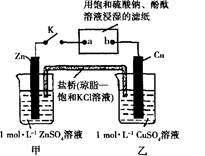
| A.电子沿Zn→a→b→Cu路径流动 |
| B.Cu电极质量增加 |
| C.甲池与乙池中的溶液互换,闭合K,电流没有明显变化 |
| D.片刻后可观察到滤纸b点变红色 |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)  2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高 SO2 的转化率 |
| D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.NH4HCO3和盐酸的反应是吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl==NH4Cl+CO2↑+H2OΔH=" +Q" kJ/mol |
下列有关化学概念或原理的论述中,正确的是
| A.任何一个氧化还原反应都可以设计为原电池,输出电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |