为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜和稀硝酸反应的产物。
实验装置如图,气密性已检查。
已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
(2)铜片和稀硝酸反应的化学方程式为 。
(3)本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
实验二 探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度<6 mol•L-1,只有NO生成。当铜片与5 mol•L-1硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如下图表。
| 时间/min |
现象 |
| 0~15 |
铜表面出现气泡,但速度很慢 |
| 25 |
溶液有很浅的蓝色,气泡生成速度加快 |
| 30 |
气泡生成速度较快,均匀冒出 |
| 45 |
洗气瓶中可见少量淡棕色的物质 |
| 50 |
溶液中蓝色明显变深,洗气瓶中突显明显棕色 |
(4)获得图2数据所需的测量仪器有________________________________。
(5)从上述图表分析可得到的结论是 。
| 序号 |
温度 |
铜片/g |
硝酸/mL |
硝酸铜/g |
| 1 |
25℃ |
① |
② |
③ |
| 2 |
25℃ |
5 |
20 |
0.5 |
| 3 |
25℃ |
5 |
20 |
1.0 |
探究二:研究化学反应产物对反应速率的影响
设计了如下实验,利用上图装置测定溶液突显明显棕色的时间。
(6)请将上表中将实验1的实验条件填写完整① ② ③
(7)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是 。
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。加入过量稀盐酸时观察到的现象是______________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有__。
(4)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________________________________。
某研究性学习小组将一定浓度的Na2CO3溶液滴入MgSO4溶液中得到白色沉淀。甲同学认为两者反应只生成MgCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Mg(OH)2一种沉淀;丙同学认为生成MgCO3和Mg(OH)2两种沉淀。(查阅资料知:MgCO3和Mg(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和MgSO4溶液反应的化学反应方程式为_____________________________;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤 ②洗涤 ③干燥。
(2)请用下图所示装置,选择合适的实验装置和必要的试剂,证明沉淀物中只有碳酸镁。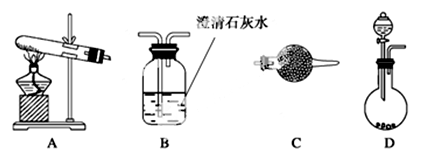
①各装置连接顺序为________________(用装置编号表示);②装置C中装有试剂的名称是______________;
③能证明生成物中只有MgCO3的实验现象是_______。
(3)若Mg(OH)2和MgCO3两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。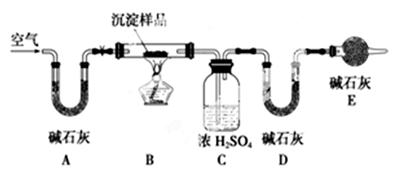
①实验结束时通入过量的空气的作用是________________________。
②A装置和E装置的共同作用是__________________________。
③实验过程中测定的数据有:W1:样品的质量,W2:反应后装置B中残渣的质量,W3:反应生成水的质量,W4:反应生成二氧化碳的质量,为了测定其组成,至少需要其中个数据,请将可能的组合填入下表中(每个空格中填一种组合,至少填5个)。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)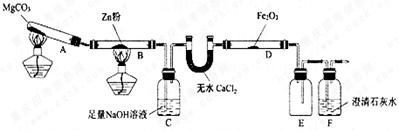
(1)MgCO3的分解产物为。
(2)装置C的作用是,处理尾气的方法为。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是。
②甲组步骤1中反应的离子方程式为。
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为。
④从实验安全考虑,题9图装置还可采取的改进措施是_____________________________。
(14分)氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式。
(2)装置a中应放试剂为,其作用为;装置c为何水平放置;
(3)该实验的操作顺序应为(用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为 ,其作用为。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在中,再加水稀释,这样操作的目的是。
(2)装置C的作用是。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式;
②请设计实验方案检验有Fe2+生成;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法(填“合理”或“不合理”),理由是。
(5)能表明I-的还原性弱于SO2的现象是。