我国拥有完全自主产权的氢氧燃料电池车已经在北京奥运会期间为运动员服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
| A.工作一段时间后,负极周围的pH增大 |
| B.工作后,电解液中的KOH的物质的量不变 |
| C.该燃料电池的总反应式为:2H2 + O2 = 2H2O |
| D.用该电池电解CuCl2溶液,产生7.1g Cl2时,电子转移0.1mol |
已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈酸性的依据是
| A.a>b |
| B.混合溶液的pH<7 |
C.混合溶液中,c(H+)> mol/L mol/L |
| D.混合溶液中,c(H+) + c(B-) = c(OH-) + c(A-) |
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定不能大量共存的离子组是
| A.Al3+ Na+NO-3 Cl- | B.K+ Ba2+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ Fe2+ SO42-NO3- |
反应:L(固)+aG(气) bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数。据此可判断
bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数。据此可判断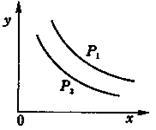
不同温度下G的体积分数
A.a>b
B.上述反应是吸热反应
C.升温K减小
D.加压K增大
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.K?(HF) | C. |
D.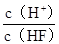 |
恒温恒压下,在容积可变的器皿中,反应2NO2(气)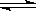 N2O4(气) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(气) 达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
| A.不变 | B.增大 | C.减小 | D.无法判断 |