下列离子方程式书写正确的是
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O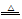 Fe(OH)3+3H+ Fe(OH)3+3H+ |
| B.一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑ |
| C.用氢氧化钠溶液吸收过量二氧化碳 OH—+CO2=HCO3— |
| D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ +2I-=2Fe2+ + I2 |
下列关于物质的用途或变化,说法正确的是
| A.Al2O3熔点很高,可用作耐火材料 |
| B.高纯度的硅单质用于制作光导纤维 |
| C.铝热反应是炼铁最常用的方法 |
| D.N2与O2在放电条件下直接化合生成NO2 |
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是: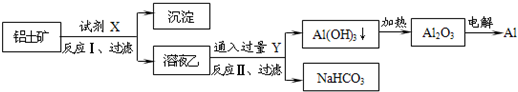
| A.试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
下列说法正确的是
| A.二氧化硫可广泛用于食品的增白 |
| B.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| D.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
| A.福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| B.大量燃烧化石燃料排放的废气中含有大量SO2,造成大气污染,从而使雨水的pH=5.6,形成酸雨 |
| C.大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
下列说法不正确的是
| A.二氧化硫不能用于食品增白 |
| B.Cl2溶于氢氧化钠溶液可以制取84消毒液 |
| C.SiO2不溶于强酸,因而它可以保存在玻璃试剂中 |
| D.NO遇空气变成红棕色 |