用NA表示阿伏加德罗常数,下列说法中正确的是
①46g NO2和N2O4的混合气体中含有的原子个数为3NA
②常温下,4 g CH4含有NA个C-H共价键
③10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8%
④标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥0.lmol·L-1Na2CO3溶液中含有0.1NA个CO32-
⑦1 mol Na2O2与水完全反应时转移电子数为2NA
| A.③⑥⑦ | B.①②⑤ | C.①②④ | D.④⑤⑥ |
下列离子方程式中书写正确的是
| A.钠与水反应:Na+2H2O=Na+=2OH—+H2↑ |
| B.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D.大理石与醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO—+CO2↑+H2O |
现代科学的发展使游离态的氮家庭又添新丁,据报道:意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
| A.N4属于一种新型的化合物 |
| B.N4沸点比P4(白磷)高 |
| C.N4与N2互为同素异形体 |
| D.1molN4气体转变为N2将吸收882kJ热量 |
在容积相同的两密闭容器A和B中,保持温度为150℃,同时向A容器中加入a mol HI,向B容器中加入b mol HI (a>b),当反应2 HI (g)  H2 (g) + I2 (g)达到平衡后,下列说法正确的是
H2 (g) + I2 (g)达到平衡后,下列说法正确的是
| A.从反应开始达到平衡,所需时间tA>tB |
| B.平衡时 C(I2)A= C(I2) B |
| C.平衡时I2 蒸气在混合气体中的体积分数:A>B |
| D.HI的平衡分解率aA=aB |
现有3个体积相等的密闭容器,都进行下列反应:CO2(g) + H2(g) H2O(g) + CO(g),反应所处的温度相同,但起始浓度 不同,其中甲:n(CO2) = n(H2) = 1 mol; 乙:n(CO2)=1 mol, n(H2)= 2 mol;丙:n(CO2) = n(H2)=n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是
H2O(g) + CO(g),反应所处的温度相同,但起始浓度 不同,其中甲:n(CO2) = n(H2) = 1 mol; 乙:n(CO2)=1 mol, n(H2)= 2 mol;丙:n(CO2) = n(H2)=n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是
| A.乙>甲>丙 | B.甲>丙>乙 |
| C.乙>丙>甲 | D.甲>乙>丙 |
在固定2L密闭容器中,充入X、Y各2 mol,发生可逆反应 X(g)+2Y(g)  2 Z(g),并达到平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图,
2 Z(g),并达到平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图,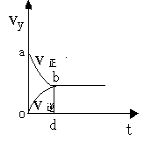
则Y的平衡浓度(mol / L)表示式正确的是(式中S指对应区域的面积)
| A.2 – S aob | B.1 – Saob |
| C.2 – S abdo | D.1 – S bod |