如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是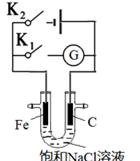
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体 |
在下列溶液中,各组离子一定能够大量共存的是:
| A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+ |
| B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
| D.碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
可逆反应a A(s)+b B(g)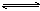 c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是
c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是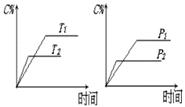
| A.达平衡后,加入催化剂则C%增大 |
| B.达平衡后,若升温,平衡左移 |
| C.化学方程式中b >c +d |
| D.达平衡后,增加A的量有利于平衡向右移动 |
下列反应的离子方程式书写中,正确的是
| A.将氨水逐滴滴加到AlCl3溶液中:Al3++3OH— |
| B.铜与稀硝酸反应:Cu+4H+ +NO3— |
| C.硫酸与氢氧化钡在溶液中反应: Ba2++OH—+H++SO42— |
| D.用FeCl3溶液腐蚀铜箔制造的印刷电路板: 2Fe3++Cu=2Fe2++Cu2+ |
在一密闭容器中充入 1mol NO2气体,建立如下平衡:2NO2 N2O4,测得NO2转化率为a%,在温度、体积不变时,再通入1mol NO2,待重新建立平衡时,测得NO2转化率为b%,a与b比较()
N2O4,测得NO2转化率为a%,在温度、体积不变时,再通入1mol NO2,待重新建立平衡时,测得NO2转化率为b%,a与b比较()
| A.a>b | B.a<b | C.a="b" | D.无法确定 |
室温时,下列混合溶液的PH一定小于7的是
| A.PH=3的盐酸和PH=11的氨水等体积混合 |
| B.PH=3的盐酸和PH=11的氢氧化钡等体积混合 |
| C.PH=3的醋酸和PH=11的氢氧化钡等体积混合 |
| D.PH=3的硫酸和PH=11的氨水等体积混合 |