25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为
| A.1.8×10-7mol/L | B.1.8×10-8 mol/L | C.1.8×10-9mol/L | D.1.8×10-10mol/L |
利用实验器材(规格和数量不限),能完成相应实验的一项是
| 实验器材(省略夹持装置) |
相应实验 |
|
| A |
烧杯、玻璃棒、蒸发皿 |
硫酸铜溶液的浓缩结晶 |
| B |
三脚架、泥三角、玻璃棒、坩埚 |
煅烧石灰石制取生石灰 |
| C |
烧杯、玻璃棒、胶头滴管、分液漏斗 |
用溴水和CCl4除去NaBr溶液中的少量NaI |
| D |
酒精灯、烧杯、导管、集气瓶 |
用KClO3固体和MnO2固体制备并收集O2 |
下列有关氯及其化合物的叙述错误的是
| A.“84”消毒液的有效成分是NaClO |
| B.AlCl3、FeCl2、CuCl2均可通过化合反应制得 |
| C.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
下列离子方程式书写正确的是
A.Cl2通入水中: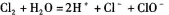 |
B.NaHCO3溶液中滴加盐酸: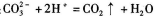 |
C.钠加入水中: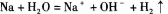 |
D.铜片放入HNO3稀溶液中: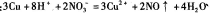 |
设阿伏加德罗常数的数值为,下列叙述正确的是
A.标准状况下,22.4L四氯化碳含有的分子数为 |
B.1 mol硫酸钾中阴离子所带的电荷数为2 |
C.0.5 mol NaOH溶液中 Na+数为0.5 NaOH溶液中 Na+数为0.5 |
D.常温常压下,16g氧气所含电子数为 |
常温下,在水溶液中能大量共存的一组离子是
| A.Na+、Ca2+、Cl-、CO32- | B.Fe2+、H+、SO42-、ClO- |
| C.Mg2+、Cu2+、Cl-、SO42- | D.K+、NH4+ 、NO3-、OH- |