为防止碘缺乏病采取的有效措施是食盐“加碘”。市场上销售的“加碘食盐”,是在食盐中加入了少量的碘酸钾(KIO3),
(1)“加碘食盐”为人体补充的是___________________(填“碘元素”或“碘单质”)
(2)计算碘酸钾的相对分子质量为____________________
(3)碘酸钾中碘元素的质量分数是____________________(计算结果保留到0.1%)
(4)若一个人一天从食盐中摄入的碘酸钾的质量为21.4mg,则进入人体的是碘元素是多少毫克?(写出计算的过程,计算结果保留到0.1 mg)。
如图1是某试剂瓶标签上的内容.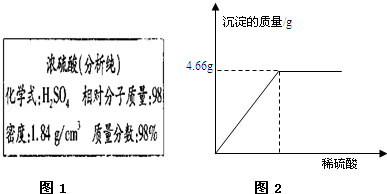
(1)要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为 39 g.在用量筒量取水时若是仰视读数,将导致稀释后的硫酸溶液质量分数 (“>”、“<”或“=”)20%
(2)试计算用上述稀释用的稀硫酸测定50gBaCl2溶液的质量分数,实验数据如图2所示,写出具体的计算过程.(已知:BaCl2+H2SO4=BaSO4↓+2HCl )
将Na2SO4和NaOH的混合物10g投入到200g溶质质量分数为4.9%的H2SO4溶液中恰好完全反应.请计算:
(1)10g混合物中NaOH的质量;
(2)最后所得溶液中溶质的质量.
如图是某试剂瓶标签上的内容.
| 浓硫酸(分析纯) 化学式:H2SO4相对分子质量:98 密度:1.84g∕cm3质量分数;98% |
(1)把这种浓硫酸稀释为溶质质量分数是19.6%的硫酸溶液100g,需要这种硫酸的质量为
(2)将稀释后的硫酸溶液与200g氢氧化钠溶液恰好完全反应,求氢氧化钠溶液的溶质质量分数.
质检人员对某品牌发酵粉中碳酸氢钠的含量进行检测.取10.0g发酵粉,向其中加入足量的盐酸,得到3.3g二氧化碳(发酵粉中其他成分不与盐酸反应).计算此品牌发酵粉中碳酸氢钠的质量分数.
“过碳酸钠”(化学式可表示为2Na2CO3•3H2O2)俗称固体双氧水,极易分解,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域.现将一定质量的过碳酸钠粉末溶于m克水中配成稀溶液,再向其中加入适量二氧化锰粉末,充分反应后生成4.8g气体.将反应后的混合物过滤,测得滤液的溶质质量分数为10.6%,求m.(不考虑损耗)