(10分)根据以下装置回答下列问题。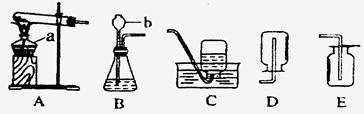
(1)写出标有字母仪器的名称:A b 。
(2)实验室制取二氧化碳气体所用的发生装置是_____(填字母),有关该反应的化学方程式为___________
(3)验证二氧化碳气体己收集满的方法是_________________________________
(4)氨气(NH3)在通常状况下是一种无色有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液为氨水。实验室可用加热氯化铵和熟石灰两种固体混合物的方法制取氨气。实验室制取氨气应选用的发生装置是_______(填字母),若用乙图装置收集氨气,气体应从______端导气管进入瓶中(填字母)。
(6)根据上述分析和选择可知,实验室制取气体选择发生装置的依据是 。若用排空气法收集气体,导气管应伸入集气瓶底部,否则 ;
下图所示是一个具有刻度和活塞可滑动的玻璃容器,其中有空气和足量的白磷,将它放在盛有沸水的烧杯上方,进行试验。请完成下图所示实验报告。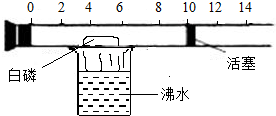
(1)实验目的:测定空气中的体积分数。
(2)实验现象:白磷着火燃烧,活塞先右移,后左移,最后停在刻度约为的位置上。
(3)现象解释:白磷着火燃烧时,活塞先右移后左移的原因:
。
(4)实验结论:空气的成分按体积计算,氧气约占。
我国科学家陈乾旺等最新研究成果表明,在440℃和800大气压条件下,二氧化碳和金属钠反应产生金刚石和碳酸钠,合成的金刚石最大达1.2mm,完全可以满足工业用途。
⑴二氧化碳与金属钠反应生成金刚石和碳酸钠的化学方程式为:。
⑵请从人类生存的角度分析,金刚石与水相比谁更宝贵?,理由是:。
根据实验示意图回答相关问题:
(1)图A中的操作错误之一是 .
(2)用图A改正后的装置进行过滤后,滤液仍浑浊的原因可能是 .
(3)用图B的方法测定空气中氧气的体积分数结果偏低,其原因是 ,改进的措施是 .
根据下列装置图,回答有关问题:
(1)利用上图中A、C装置的组合可以制取某种气体,实验室制取该气体的化学方程式是
,验满方法是。
(2)实验室通常利用上图中装置的组合制取二氧化碳(选填字母),该反应的化学方程式为。
①为了得到纯净、干燥的二氧化碳气体,除杂装置(如右图)的导管按气流方向连接顺序是(选填字母)。
A.a→b→c→d B.b→a→c→d
C.c→d→a→b D.d→c→b→a
②常用澄清石灰水检验二氧化碳的存在,该反应的化学方程式为;若二氧化碳过量,二氧化碳又会与碳酸钙、水反应生成易溶的碳酸氢钙[Ca(HCO3)2],该反应的化学方程式为。向含有氢氧化钙14.8g的石灰水里缓缓通入一定量二氧化碳,充分反应后若生成10g沉淀,则通入二氧化碳的质量可能为(选填字母)。
A.4.4g B.8.8g C.13.2g D.17.6g
实验室中验证金属活动性顺序的方法很多,请用三种方法验证铁、铜、银的活动性顺序(只写出所需试剂即可)。