美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供。因其独特的放电方式,也称呼吸式电池。负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液。中间设有用于隔开正极和负极的锂离子固体电解质。正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合。如图所示。下列说法不正确的是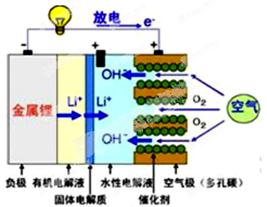
| A.负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形式溶于有机电解液,电子供应给导线。溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中。 |
| B.正极反应:O2+2H2O+4e- =4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环。 |
| C.在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应。 |
| D.锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止。 |
现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑②H++CO32—===HCO3— ③CO2+H2O+ClO-===HClO+HCO3— ④CO32—+HSO3—===HCO3—+SO32—,由此得出的如下结论中不正确的是( )
| A.CO32—与H+、Ca2+不能大量共存 | B.H2CO3的酸性比HClO强,比H2SO3弱 |
| C.H2SO3是一种强酸 | D.H2CO3、HClO都属于弱酸 |
下列离子方程式正确的是( )
| A.NaHSO3溶液中投入过氧化钠粉末:2HSO3—+2Na2O2===2SO32—+O2↑+4Na++H2O |
B.惰性电极电解氯化钠溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| C.氢氧化钙溶液与过量碳酸氢钠溶液反应:HCO3—+Ca2++OH-===CaCO3↓+H2O |
| D.向溴化亚铁溶液中滴加少量氯水:2Br-+Cl2===Br2+2Cl- |
在下列各溶液中,离子一定能大量共存的是( )
| A.强碱性溶液中:K+、Al3+、Cl-、SO42— |
| B.含有0.1 mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3— |
| C.含有0.1 mol·L-1Ca2+的溶液中:Na+、K+、CO32—、Cl- |
| D.室温下,pH=1的溶液中:Na+、Fe3+、NO3—、SO42— |
下列说法正确的是( )
| A.电解质溶液的浓度越大,其导电性能一定越强 |
| B.强酸和强碱一定是强电解质,不论其水溶液浓度大小,都能完全电离 |
| C.强极性共价化合物不一定都是强电解质 |
| D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强 |
下列说法不正确的是( )
| A.Na2O2、HClO、SO2等物质都具有漂白作用 |
| B.液氨、液氯、液态氯化氢都是电解质 |
| C.所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应 |
| D.非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |