还原沉淀法是处理含铬(含Cr2072-和CrO42-)工业废水的常用方法,过程如下: 已知转化过程中的反应为
已知转化过程中的反应为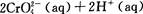
 。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2072-,下列说法不正确的是
。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2072-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeS04·7H20)(M=278)作还原剂,处理1 L废水,至少需要917.4 g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的PH=6 |
| D.常温下Ksp[Cr(OH)3]="1" X 10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的PH=5 |
下列各项比较中,错误的是
| A.原子半径:Li < Na < K | B.酸性: H2SiO3 < H2CO3 < HNO3 < HClO4 |
| C.稳定性: SiH4 > H2S > HF | D.碱性: NaOH > Mg(OH)2 > Be (OH)2 |
下列不可能属于可逆反应的是
| A.氯气与水反应生成盐酸与次氯酸 |
B.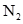 与 与 在一定条件下可以生成 在一定条件下可以生成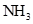 ,同时 ,同时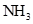 又可分解为 又可分解为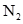 和 和 |
C.电解水生成 和 和 ,氢气和氧气转化成 ,氢气和氧气转化成 |
D.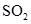 溶于水和 溶于水和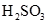 分解 分解 |
下列叙述正确的是
| A.离子化合物可能含共价键 | B.共价化合物可能含离子键 |
| C.单质中一定不含共价键 | D.离子化合物中一定含有金属离子 |
下列物质中,属于含有共价键的离子化合物的是
| A. KOH | B. Br2 | C. MgCl2 | D.H2S |
下列转化不属于煤或石油的综合利用的是
| A.将煤干馏制得煤焦油和焦炭 | B.在一定条件下将煤与氢气转化为液体燃料 |
| C.将煤变为煤饼作燃料 | D.将石油裂解制得乙烯等化工原料 |