在一定条件下,红棕色的NO2可以发生如下反应:2NO2(g)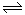 2NO(g)+O2(g)下列叙述中正确的是
2NO(g)+O2(g)下列叙述中正确的是
| A.恒温恒容,充入N02气体,其转化率增大 |
| B.加压,平衡向逆反应方向移动,混合气体颜色变深 |
| C.若平衡常数增大,则可能是升高了温度或减小了体系的压强 |
| D.当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
如果你家里的花生油中混有水份,你将采用下列何种方法分离
A.过滤 B蒸馏 C.分液 D.萃取、
等质量的钠进行下列实验,其中生成氢气最多的是
| A.将钠投入到足量水中 | B.将钠用铝箔包好并刺一些小孔再放人足量的水中 |
| C.将钠放入足量稀硫酸中 | D.将钠放入足量稀盐酸中 |
下列物质存放方法错误的是
| A.Cl2水置于棕色试剂瓶避光保存 | B.盛NaOH溶液的试剂瓶用磨口玻璃塞 |
| C.FeSO4溶液存放在加有少量铁粉的试剂瓶中 | D.金属钠存放于煤油中 |
自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是
| A.AgNO3 | B.FeCl2 | C.Na2SO3 | D.AlCl3 |
在相同条件下,下列说法错误的是
| A.氯气在饱和食盐水中的溶解度小于在纯水中的溶解度 |
| B.NO可用排空气法进行收集 |
| C.碳酸的酸性比硅酸强 |
| D.SO2的大量排放会引起酸雨 |