在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
| A.原溶液中n(Mg2+)∶n(Al3+)=10∶1 |
| B.原溶液的c(H+)=0.8mol/L |
| C.x与y的差值为0.01 mol |
| D.原溶液中c(Cl-)=0.66mol/L |
对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯: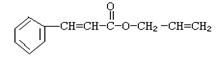 可简化为
可简化为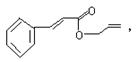
杀虫剂“阿乐丹”的结构表示为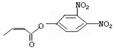 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是()
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是()
| A.遇FeCl3溶液均显紫色 | B.均能发生银镜反应 |
| C.均不能与钠发生反应 | D.均能与NaOH溶液发生反应 |
设NA为阿伏加德罗常数的值,下列有关说法正确的是()
| A.0.5 mol苯分子中含有C=C双键数为1.5 NA |
| B.1 mol甲基(—CH3)所含的电子总数为8 NA |
C.标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为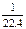 NA NA |
| D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
分子式为C10H20O2有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条件下可转化成D,则A的可能结构有()
| A.2种 | B.3种 | C.4种 | D.5种 |
下列实验能获得成功的是()
| A.苯和浓溴水用Fe作催化剂制溴苯 |
| B.氯乙烷与NaOH溶液共热,水解后加入AgNO3溶液检验Cl- |
| C.CH4和Cl2光照制得纯净的CH3Cl |
| D.乙烯通入含Br2的CCl4溶液制得CH2BrCH2Br |
有八种物质:①甲烷、②苯、③聚乙烯、④苯酚、⑤2—丁炔、⑥环己烷、⑦邻一二甲苯、⑧环己烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是 ( )
| A.③④⑤⑧ | B.④⑤⑦⑧ | C.④⑤⑧ | D.③④⑤⑦⑧ |