过氧化钾与水的反应类似于过氧化钠与水的反应,其化学方程式为:2K2O2+2H2O=4KOH+O2↑
当0.5molK218O2与足量H2O完全反应后,下表对生成物O2的叙述中错误的是
| |
K218O2的质量 |
O2的叙述 |
| A |
57g |
O2的质量是9g |
| B |
57g |
生成标准状况下O2的体积为5.6L |
| C |
57g |
O2的摩尔质量是32g·mol-1 |
| D |
57g |
生成0.25mol O2 |
若某原子的摩尔质量是Mg·mol-1,则一个该原子的真实质量是
下列条件下,两瓶气体所含原子数一定相等的是
①同质量、不同密度的N2和CO;②同温度、同体积的N2和H2;
③同体积、同密度的C2H4和C3H6;④同压强、同体积的N2O和CO2
| A.①② | B.②③ |
C.③④ | D.①③ |
下列仪器使用前必须检查其是否漏水的是
①分液漏斗②蒸馏烧瓶③冷凝管④容量瓶⑤蒸发皿⑥长颈漏斗
| A.②⑥ | B.①④ | C.③④ | D.③⑤ |
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达错误的是
A.密闭容器中CuO和C高温反应的气体产物: 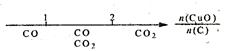 |
B.Fe在Cl2中的燃烧产物: 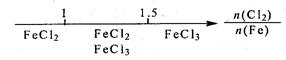 |
C.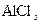 溶液中滴加NaOH后铝的存在形式: 溶液中滴加NaOH后铝的存在形式: 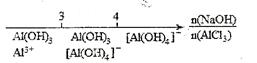 |
D.氨水与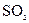 反应后溶液中的铵盐: 反应后溶液中的铵盐: |

国际无机化学命名委员会将长式元素周期表原先的主、副族号取消,从左往右改为18列,碱金属为第 1列,稀有气体为18列。按这个规定,下列说法错误的是
1列,稀有气体为18列。按这个规定,下列说法错误的是
| A.只有第2列元素的原子最外层有2个电子 |
| B.第3~12列中的元素都是金属元素 |
| C.室温时,第18列元素的单质都是气体 |
| D.第16、17列元素都是主族元素 |