稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素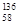 Ce、 Ce、 Ce、 Ce、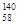 Ce、 Ce、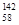 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
下列说法正确的是
| A.任何晶体中,若含有阳离子也一定含有阴离子 |
| B.金属镁的熔点、硬度高于铝 |
| C.在铜的晶胞结构中,每个晶胞中平均有4个铜原子,铜原子的配位数为6 |
| D.金属具有良好的导电性,是因为在金属晶体中共享了金属原子的价电子,形成了“电子气”,在外电场的作用下自由电子定向移动便形成了电流,所以金属易导电。 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(H2O)4]2+ |
| C.该实验能证明[Cu(NH3)4]2+比氢氧化铜稳定 |
| D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
下列现象与氢键有关的是
①HF的熔、沸点比ⅦA族其他元素氢化物的高
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
| A.②③④⑤ | B.①②③⑤ | C.①②③④ | D.①②③④⑤ |
已知大多数含氧酸可用通式XOm(OH)n来表示,如X是S,则m =2,n =2,则这个式子就表示H2SO4。一般而言,该式中m大于等于2的是强酸,m为0的是弱酸。下列各含氧酸中酸性最强的是
| A.H2SeO3 | B.HMnO4 | C.H3BO3 | D.H3PO4 |
关于结构如图所示的有机物的叙述中正确的是
| A.1mol此有机物与足量Na发生反应,有3molH2生成 |
| B.分子中有3个手性碳原子 |
| C.分子中sp2、sp3杂化的原子个数比为1∶1 |
D.1mol此有机物与足量H2发生加成反应,有2mol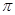 键断裂 键断裂 |