写出下列化合物的名称或结构简式:
(1)结构简式为 此烃名称为 。
此烃名称为 。
(2)结构简式为 的烃可命名为 。
的烃可命名为 。
(3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(4)结构简式为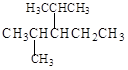 的烃可命名为: 。
的烃可命名为: 。
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
温度 浓度 时间 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为。
②实验2,CH3OH(g)的初始浓度c2=mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3v1(填>、=、<),且c3=mol/L。
在体积为1 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
| T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的平衡常数表达式K=__________,升高温度,化学平衡向__________
(填“正反应”或“逆反应”)方向移动。
(2)能判断该反应达到化学平衡状态的依据是________。
A c(CO2)=c(CO) B K不变 C容器中的压强不变
D.v正(H2)=v正(CO2) E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温
度为_____;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol
CO、1.5 mol H2O,则此时反应朝______方向进行(填“正反应”、“逆反应”)。
(1)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+ O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是。
某同学认为,铝热反应可用于工业炼铁,你的判断是(填“能”或“不能”),
你的理由是。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为。
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生
反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反
应是(填“吸热”或“放热”)反应。
②500℃达平衡时,CH3OH的体积分数为。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(1)中反应的逆反应。
已知:起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为L(连通管中气体体积忽略不计,且不考虑温度的影响)。
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D 增加CO的浓度E 分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
温度 浓度 时间 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为。
②实验2,CH3OH(g)的初始浓度c2=mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3v1(填>、=、<),且c3=mol/L。