A、B、C都是金属,A中混有C时,A先腐蚀;A与B组成原电池时,A为电池的正极,则A、B、C三种金属的活动性顺序为( )
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
胶体的最本质的特征是()
| A.丁达尔效应 | B.可以通过滤纸 |
| C.布朗运动 | D.分散质粒子的大小在1nm~100nm之间 |
下列说法中正确的是()
| A.摩尔是物质质量的单位,用“mol”表示 |
| B.标准状况下,气体摩尔体积约为22.4 mol/L |
| C.阿伏伽德罗常数的真实值为6.02×1023 |
| D.物质的量浓度的常用单位是mol/L |
下列实验操作中,不正确的是() 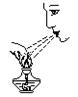
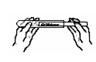

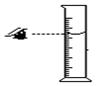
| A.熄灭酒精灯 | B.取用固体粉末 | C.滴加液体 | D.读液体体积 |
已知丙酮通常是无色的液体,不溶于水,密 度小于1 g•cm-3,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,应选用()
度小于1 g•cm-3,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,应选用()
| A.过滤 | B.蒸馏 | C.分液 | D.蒸发 |
图标 所警示的是(
所警示的是(  )
)
| A.当心火灾——氧化剂 | B.当心火灾——易燃 物质 物质 |
| C.当心爆炸——自燃物质 | D.当心爆炸——爆炸性物质 |