在解释下列物质的性质变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
| A.与硅相比,金刚石的硬度大,熔点高 |
| B.HF、HCl、HBr、HI热稳定性依次减弱 |
| C.F2、Cl2、Br2、I2的沸点逐渐升高 |
| D.F2比O2更容易与H2反应 |
常温下,某强酸溶液的PH=a,强碱溶液的PH=b,已知a+b=12,酸碱溶液混合后PH=7,则酸溶液的体积V(酸)和碱溶液体积V(碱)的正确关系是:A
| A.V(酸)=102V(碱) | B.V(碱)=102V(酸) |
| C.V(酸)=2V(碱) | D.V(碱)=2V(酸) |
在密闭容器中,对于可逆反应A+3B 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是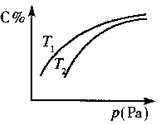
| A.若正反应方向的△H<0,则T1>T2 |
| B.A一定为气体 |
| C.B一定为气体 |
| D.压强增大时,混合气体的平均相对分子质量一定减小 |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
| A.V3>V2>V1 | B.V1>V2>V3 | C.V3>V2=V1 | D.V1=V2>V3 |
将pH= l的盐酸平均分成 2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
| A.9 | B.10 | C.11 | D.12 |
在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是
| A.pH=3的HNO3跟pH=11的KOH溶液 | B.pH=3的盐酸跟pH=11的氨水 |
| C.pH=3硫酸跟pH=11的氢氧化钠溶液 | D.pH=3的醋酸跟pH=11的氢氧化钠溶液 |