(6分)现有下列物质, 用编号填空回答下列各问:
| A.干冰 |
| B.金刚石 |
| C.氩 |
| D.晶体硅 |
E.过氧化钠
F.二氧化硅
G.溴化铵
(1)通过非极性键形成的晶体是___________。
(2)固态时属于不含化学键的分子晶体是________。
(3)含有极性键的分子晶体是 。
(4)由极性共价键形成的晶体是_______ 。
(5)含有非极性键的离子化合物是 。
(6)含有离子键、共价键、配位键的化合物是 。
下表标出的是元素周期表的一部分元素,回答下列问题:
| 1 |
||||||||||||||||||
| 2 |
D |
B |
A |
|||||||||||||||
| 3 |
J |
I |
H |
C |
G |
F |
E |
|||||||||||
| 4 |
L |
K |
N |
|||||||||||||||
| 5 |
M |
|||||||||||||||||
| 6 |
(1)表中用字母标出的14种元素中,化学性质最不活泼的是(用元素符号表示,下同),非金属性最强的是,常温下单质为液态的非金属元素是.J、C、F中,原子半径最小的元素是;属于过渡元素的是(该空用字母表示),第六周期的元素共有种。
(2)F,C气态氢化物中其中以(填化学式)最不稳定;第三周期对应的碱性最强的最高价氧化物的水化物的化学式是,该物质含有的化学键类型是,用该物质做焰色反应实验,火焰呈色。
(3)N元素在周期表中的位置是,写出由F单质制取N单质的离子方程式是。
生活中的一些问题常涉及化学知识,下列叙述不正确的是(填序号)
。
①淀粉、蛋白质都是天然有机高分子化合物
②食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
③禁止使用含铅汽油是为了提高汽油的燃烧效率
④洗涤剂去污是物理变化,碱液去污属于化学变化
⑤随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
⑥现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,他们都属于碳氢化合物
⑦福尔马林是一种良好的杀毒剂,也可用来消毒自来水
⑧为保证加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸。
(1)工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。写出用铂铑合金作催化剂由氨氧化制备硝酸的第一步反应的化学方程式 ▲。浓硝酸和浓硫酸的混合酸是有机合成中常用的硝化剂,写出将苯滴入浓硝酸和浓硫酸混合液中,并在50℃--60℃反应的化学方程式 ▲。
(2)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。则硝酸在该反应中的作用是 ▲。如果得到的NO和NO2物质的量相同,写出并配平该反应的离子方程式 ▲,0.6mol Cu被硝酸完全溶解后,若用排水法收集这些气体,可得标准状况下的气体体积为 ▲。
下表为元素周期表的一部分,元素①-⑦是短周期的主族元素,请参照元素①-⑥在表中的位置,回答下列问题:
| ① |
② |
|||||
| ③ |
④ |
⑤ |
⑥ |
⑦ |
(1)写出⑥在元素周期表中的位置 ▲。
(2)②的气态氢化物的沸点 ▲⑥的气态氢化物的沸点。(填大于、小于或等于)
(3)④的最高价氧化物与③的最高价氧化物对应的水化物的水溶液反应的离子方程式为
▲。
(4)①和⑤形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是 ▲, 与该化合物晶体类型相同的是___▲___(请用相应的编号填写)。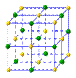
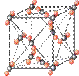
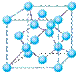
A B C
(5)由①和③形成的化合物甲和乙,甲受到撞击会分解生成一种固体单质和一种气体单质,此反应中反应物、固体单质和气体单质的物质的量之比是2:2:3;乙中加入过量的盐酸后生成两种盐,在其中一种盐中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体。则化合物甲的化学式为 ▲,化合物乙与过量盐酸反应的化学方程式为 ▲。
I:能源是人类生活和社会发展的基础,地球上最基本的能源是 ▲,大自然利用这一能源最成功的是 ▲。氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水。)请写出氢气燃烧的热化学方程式 ▲。
Ⅱ:理论上任意一个自发的氧化还原反应都能设计成原电池,现有如下反应:
2FeCl3 + Cu = 2FeCl2 + CuCl2
如果将其设计成原电池,请写出负极材料及正极电极反应式。
负极材料: ▲;正极电极反应式: ▲。
III:工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出工业用电解熔融氧化铝制取铝的化学方程式: ▲。
(2)现冶炼2.7 t 铝,需要转移电子的物质的量为 ▲mol。