700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
H2O/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数不变
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
下列物质能够自身聚合成高分子化合物的是( )
| A.CH3CH2OH | B.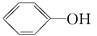 |
C.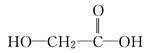 |
D.CH3COOH |
某高聚物的结构片段如下: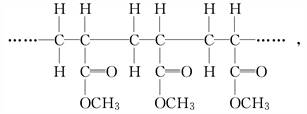
下列分析正确的是( )
| A.它是缩聚反应的产物 |
| B.其单体是CH2===CH2和HCOOCH3 |
| C.其链节是CH3CH2COOCH3 |
| D.其单体是CH2===CHCOOCH3 |
某高分子化合物的部分结构如下: 下列说法中正确的是( )
下列说法中正确的是( )
| A.若n为聚合度,则该物质的相对分子质量为97n |
B.该聚合物的链节是 |
| C.该聚合物的化学式为(C3H3Cl3)n |
| D.单体是CH2===CHCl |
生成高聚物 的单体有( )
的单体有( )
| A.1种 | B.2种 |
| C.3种 | D.4种 |
下列关于乙烯和聚乙烯的叙述中正确的是( )
| A.二者都能使溴水褪色,性质相似 |
| B.二者互为同系物 |
| C.二者最简式相同 |
| D.二者分子组成相同 |