写出下列反应的化学方程式,并指出反应类型:
(1)实验室制乙烯 ( )
(2)用甲苯制备TNT ( )
(3)苯酚和浓溴水的反应 ( )
(4)1,2-二溴乙烷与足量氢氧化钠的乙醇溶液加热: ( )
(5)2-丙醇与氧气在催化剂作用下反应 ( )
(10分)(1)键线式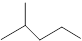 表示的分子式;
表示的分子式;
名称。
(2)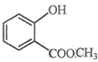 中含有的官能团的名称为。
中含有的官能团的名称为。
(3)写出下列物质的结构简式:
2,6-二甲基-4-乙基辛烷:。
(4)写出该物质的名称: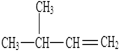 。
。
(共16分)请根据官能团的不同对下列有机物进行分类。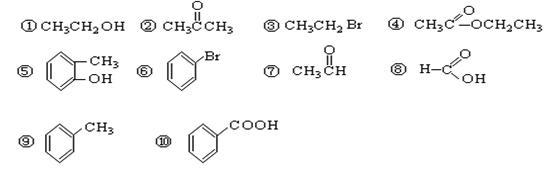
(1)芳香烃:;
(2)卤代烃:;
(3)醇:;
(4)酚:;
(5)醛:;
(6)酮:;
(7)羧酸:;
(8)酯:。
【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
| 氟 |
氯 |
溴 |
碘 |
|
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、“<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
【化学—选修2:化学与技术】
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是;
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |
II、合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是,;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式,;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称,其中发生的化学反应方程式为;
(3)设备B的名称,其中m和n是两个通水口,入水口是(填“m”或“n”)。不宜从相反方向通水的原因;
(4)设备C的作用;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于。
、资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=" -76.0" kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H="+113.4" kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2(g) 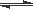 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则300℃时上述反应的平衡常数K=____________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)0。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示: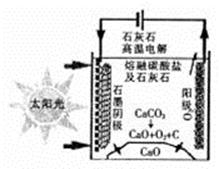
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能 b、太阳能转化为电能
c、太阳能转化为化学能d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-,则阳极的电极反应式为___________________。