T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分含量与时间的关系如图-2所示。下列分析正确的是( )
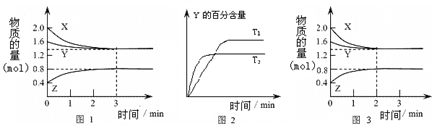
A.容器中发生的反应可表示为:3X(g)+Y(g) 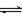 2Z(g) 2Z(g) |
| B.0~3 min内,v(X)=0.2 mol•L-1•min-1 |
| C.其他条件不变升高温度,v正、v逆都减小,且重新平衡前v正<v逆 |
| D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强 |
下列物质不属于“城市空气质量日报”报道的是()
| A.二氧化氮 | B.二氧化硫 | C.可吸入颗粒物 | D.二氧化碳 |
下列物质中只含有离子键的是()
| A.H2O | B.NaCl |
| C.NH4Cl | D.CCl4 |
下列物质不能与镁反应的是()
| A.氩气 | B.氯气 | C.盐酸 | D.氧气 |
下列关于有机反应类型的说法错误的是()
| A.甲烷与氯气的反应属于取代反应 |
| B.乙烯与氢气的反应属于加成反应 |
| C.乙酸与乙醇的反应属于酯化反应 |
| D.苯与硝酸的反应属于加成反应 |
检验溶液中是否含有Cl-,选用的试剂是稀硝酸和AgN O3溶液,其中稀硝酸的作用是()
O3溶液,其中稀硝酸的作用是()
| A.加速反应的进行 | B.排除某些杂 质离子的干扰 质离子的干扰 |
| C.生成不溶于水的物质 | D.加大沉淀的生成量 |