已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确的是( )
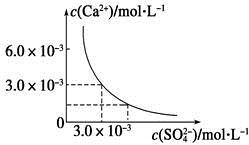
| A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 |
| C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大 |
当光束通过下列分散系:① 尘埃的空气 ② 稀硫酸 ③ 蒸馏水 ④ 墨水, 能观察到有丁达尔现象的是
| A.①② | B.②③ | C.①④ | D.②④ |
已知溶质质量为96%的酒精溶液的物质的量溶度为16.6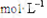 ,试判断48%的酒精溶液的物质的量浓度
,试判断48%的酒精溶液的物质的量浓度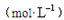 (已知酒精的密度小于1)
(已知酒精的密度小于1)
把VL含有 的混合溶液分成两等份,一份加入含
的混合溶液分成两等份,一份加入含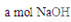 的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含
的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含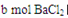 的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为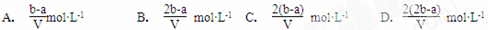
下列依据实验目的所设计的实验操作中正确的是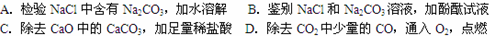
下列实验中所选用的仪器正确的是
| A.用200mL量筒量取5.2mL稀硫酸 |
| B.用托盘天平称量11.7g氯化钠固体 |
| C.用瓷坩埚灼烧纯碱 |
| D.用50mL烧杯配制100g质量分数为5%的食盐水 |