下列离子方程式正确的是( )
| A.Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO- |
| B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
将锌片和银片接触放入相同物质的量浓度的下列溶液中,反应一段时间后,溶液质量减轻的是()
| A.氯化铝 | B.硫酸铜 | C.硝酸银 | D.稀硫酸 |
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和1/2O2+H2O+2e-=2OH-,则下列叙述正确的是()
| A.通H2的一极是正极,通O2的一极是负极 |
| B.通O2的一极是正极,通H2的一极是负极 |
| C.工作一段时间后电解质溶液pH增大 |
| D.工作时负极区附近pH减小 |
表明金属甲比乙的活动性强的叙述不正确的是()
| A.甲能与稀盐酸反应生成H2而乙不能 |
| B.将甲、乙组成原电池,甲为负极 |
| C.在氧化还原反应中甲比乙失去电子多 |
| D.在氧化还原反应中甲比乙容易失去电子 |
将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是()
| A.正极附近SO42—的浓度逐渐增大 | B.负极附近SO42—的浓度逐渐减小 |
| C.负极附近SO42—的浓度逐渐增大 | D.正极附近SO42—的浓度基本不变 |
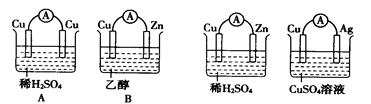
如下图的装置能构成原电池并产生较强的电流的是()