下列化学实验事实及其解释或结论都正确的是( )
| A.用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH |
| B.向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 |
| C.向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 |
| D.取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
关于合金性质的说法中,错误的是()
| A.多数合金的硬度一般比其各成分金属的硬度高 |
| B.多数合金的熔点一般比其各成分金属的熔点低 |
| C.合金的物理性质一般与其各成分金属的物理性质不同 |
| D.合金的化学性质一般与其各成分金属的化学性质不同 |
某有机物的结构简式如右下式,该有机物不可能具有的性质是( )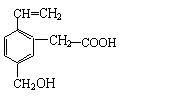
| A.能跟NaOH溶液反应 |
| B.能使酸性KMnO4溶液褪色 |
| C.能发生水解反应 |
| D.能发生酯化反应 |
分子式为C5H12O的饱和一元醇,其分子中含有两个—CH3,两个—CH2—,一个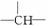 和一个—OH,它的可能结构是 ( )
和一个—OH,它的可能结构是 ( )
| A.2种 | B.3种 | C.4种 | D.5种 |
乙醇催化氧化为乙醛过程中化学键的断裂与形成情况可表示如下: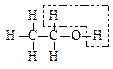

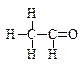 (注:含-CHO的物质为醛类化合物)
(注:含-CHO的物质为醛类化合物)
下列醇不能被氧化为醛类化合物的是()
| A.CH3OH | B.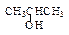 |
C.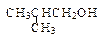 |
D.CH3CH2CH2OH |
下列比较关系与排列顺序不正确 的是()
的是()
| A.酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| B.熔沸点:HF<HCl<HBr<HI |
| C.还原性:SiH4>NH3>H2O>HF |
D.半径:Al3 +<Mg2+<Na+<F- +<Mg2+<Na+<F- |