下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.汽车底盘喷涂高分子膜 | D.地下钢管连接镁块 |
甲、乙两种物质的溶解度曲线如下图所示:下列说法一定正确的是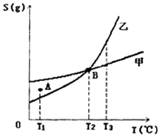
| A.A点表示示T1℃时甲的溶液已饱和,乙的溶液未饱和 |
| B.B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物质的量浓度相等 |
| C.将T3℃(时甲、乙两物质的饱和溶液分)分别降温至T2℃,析出的乙比析出的甲多 |
| D.若乙中含有少量的甲,可用重结晶的方法提纯乙 |
11.6gFe3O4加到100mL某浓度的盐酸中,再加入9.8g铁粉,反应停止时,溶液中无固体存在。立即往溶液中通入氮气,同时滴加5.0mol/LNaOH溶液到溶液中,金属离子刚好生成白色沉淀,共消耗NaOH溶液160mL。则原盐酸的物质的量浓度为
| A.2mol/L | B.4 mol/L | C.6 mol/L | D.8mol/L |
下列说法或表示法正确的是
| A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)→C(金刚石);ΔH =+1.19 kJ· mol—1可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ· mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| D.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ· mol—1 |
在一定条件下,RO3n-+2R2-+6H+=3R+3H2O,下列关于R元素的叙述中,一定正确的是
| A.R原子的最外层上有4个电子 | B.RO3n-中的R只能被还原 |
| C.R的单质可能既有氧化性又有还原性 | D.H3RO3一定是强酸 |
若某装置中发生如下反应:Cu+2H+=Cu2++H2↑,关于该装置的有关说法不正确的是
| A.该装置一定为原电池 |
| B.该装置一定为电解池 |
| C.金属铜为电解池的阳极 |
| D.电解质溶液可能是硝酸溶液 |