H2S水溶液中存在电离平衡H2S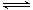 H++HS-和HS-
H++HS-和HS-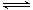 H++S2-。下列说法正确的是( )
H++S2-。下列说法正确的是( )
| A.若向H2S溶液中加水,平衡向右移动,溶液中氢离子浓度增大 |
| B.通入过量SO2气体,平衡向左移动,溶液pH值增大 |
| C.滴加新制氯水,平衡向左移动,溶液pH值减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |
将1.0g Al2O3和MgO的混合物,溶解在过量的100mL浓度为0.5mol/L的硫酸溶液中,然后向其中加入NaOH溶液,使Al3+、Mg2+刚好全部转化为沉淀,所用100mLNaOH溶液的物质的量浓度为
| A.0.5mol/L | B.1.0mol/L | C.1.5mo l/L | D.2.0 mo l/L |
下列各种方法中,不适用于炼制相应金属的是
| A.加热氧化汞冶炼汞 | B.电解熔融氯化钠冶炼钠 |
| C.煅烧辉铜矿(主要成分Cu2S)冶炼铜 | D.氧化镁跟铝粉共热冶炼镁 |
右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶管的胶头,下列与试验事实不相符的是
| A.CO2(NaHCO3溶液) 无色喷泉 |
| B.NH3(H2O含酚酞) 红色喷泉 |
| C.H2S(CuSO4溶液) 黑色喷泉 |
| D.HCl(AgNO3溶液) 白色喷泉 |
工业上制取硫酸铜不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断地从容器下部吹入细小的空气泡,这样做的优点是
① 节省能源 ② 不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率
| A.①② | B.②③④ | C.①②③ | D.全部 |
下列反应的离子方程式, 正确的是
| A.碳酸镁溶于浓硝酸中MgCO3+2H+=Mg2++H2O+CO2↑ |
| B.氧化铁溶于氢碘酸Fe2O3+6H+=2Fe3++3H2O |
| C.向漂白粉溶液中通入少量SO2气体H2O+Ca2++SO2+2ClO-=CaSO3+2HClO |
| D.FeBr2溶液中通入足量的Cl2:2Cl2+2Fe2++2Br-=4Cl-+2Fe 3++Br2 |