某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
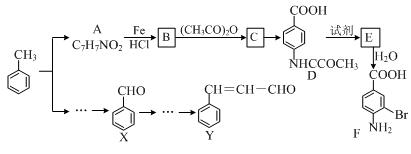
已知:①


②2CH3CHO  CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)下列有关F的说法正确的是 。
| A.分子式是C7H7NO2Br |
| B.能形成内盐 |
| C.能发生取代反应和缩聚反应 |
| D.1 mol的 F最多可以和2 mol NaOH反应 |
(2)C→ D的反应类型是 。
(3)B→C的化学方程式是 。
在合成F的过程中,B→C步骤不能省略,理由是 。
(4)D→E反应所需的试剂是 。
(5)写出同时符合下列条件的A的同分异构体的结构简式 (写出3个)。
①苯环上只有两种不同化学环境的氢原子
②分子中含有 -CHO
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3
下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品 名 |
浓缩菠萝汁 |
| 配 料 |
水.浓缩菠萝汁.蔗糖.柠檬酸.黄原胶.甜蜜素.维生素C,菠萝香精.柠檬黄.日落黄.山梨酸钾等 |
| 果汁含量 |
≥80% |
| 生产日期 |
标于包装袋封口上 |
其中属于着色剂的有 ,属于调味剂的有 ,属于防腐剂的有 。
丙烯是石油化工的重要原料,一定条件下可发生下列转化:
已知: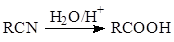

(1)A的结构简式为:;
(2)反应④的类型为:反应;
(3) D与足量乙醇反应生成E的化学方程式为:。
(4) 与足量NaOH溶液反应的化学方程式为。
与足量NaOH溶液反应的化学方程式为。
(5)B的同分异构体有多种.写出其中既能发生银镜反应,又能发生酯化反应的2种同分异构体的结构简式:、。
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式。
(2)1molB与溴水充分反应,需消耗mol单质溴。
(3)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
请写出 下列反应的化学方程式:
下列反应的化学方程式:
(1)氯乙烷在氢氧化钠水溶液中加热的反应:
(2)乙烯与水用硫酸作催化剂在加热条件下发生加成反应:
系统命名法(IUPAC)命名下列有机物
(1)
(2)