原子结构决定元素的性质,下列说法中,正确的是( )
| A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 |
| B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高 |
| C.第2周期元素的最高正化合价都等于其原子的最外层电子数 |
| D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
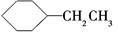
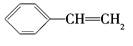
下列有机化合物的分类不正确的是
| A |
B |
 |
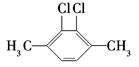 |
| 苯的同系物 |
芳香族化合物 |
| C |
D |
 |
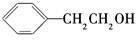 |
| 不饱和烃 |
醇 |
铁与稀硫酸反应制取氢气,下列措施一定能使生成氢气的速率加快的是
| A.增大硫酸的浓度 | B.减小硫酸的浓度 |
| C.增加铁的量 | D.加热 |
在一定条件下,反应N2+3H2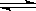 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.V(NH3)=0.02mol/(L·min) | B.V(N2)=0.005mol/(L·min) |
| C.V(NH3)=0.17mol/(L·min) | D.V(H2)=0.03mol/(L·min) |
某元素的气态氢化物的化学式为HX,则X的最高价氧化物的水化物的化学式为
| A.HXO4 | B.HXO3、 | C.HXO | D.H2XO4 |
关于下图装置的叙述,错误的是
| A.铜是正极,其质量不变 |
| B.氢离子在铜表面被氧化,产生气泡 |
| C.电流从铜片经导线流向锌片 |
| D.电子从锌片经导线流向铜片 |