常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
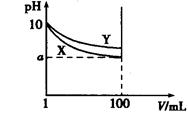
| A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,X溶液的碱性比Y溶液的碱性强 |
| C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积Vx>Vy |
| D.若8<a<10,则X、Y都是弱碱 |
室温下,对于醋酸及其盐的下列判断正确的是
| A.稀醋酸溶解石灰石的离子方程式为CaC03+2H+=Ca2++H20+C02↑ |
| B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大 |
| C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如上图 |
| D.CH3COONH4溶液和K2S04溶液均显中性,两溶液中水的电离程度相同 |
以石油为原料制备乙醇的转化流程图如下所示:
跟上述流程图相关的说法中正确的是
| A.流程图①中产物均为烃类,产物均为可燃性气体 |
| B.流程图①中需减压分馏,②中需分馏分离出乙烯 |
| C.流程图③中发生加成反应,④中发生取代反应 |
| D.乙醇、硫酸都能够使蛋白质变性,都可用于皮肤消毒 |
次氯酸钠能有效地杀灭水中的细菌和病毒。该过程不可能涉及的变化有
| A.置换反应 | B.复分解反应 | C.电离 | D.水解 |
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
下列实验操作能达到实验目的的是
| 选项 |
实验目的 |
实验操作 |
| A |
检验蔗糖水解产物中的葡萄糖 |
取1 mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2,加热 |
| B |
除去乙烷中混有的少量乙烯 |
将混合气体通入足量酸性KMnO4溶液中 |
| C |
验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
向2 mL 1 mol/L NaOH溶液中加入几滴1 mol/L MgCl2溶液,生成白色沉淀,再加入几滴1 mol/L FeCl3溶液 |
| D |
硅酸胶体的制备 |
向Na2SiO3溶液(饱和溶液1 : 2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失 |