某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
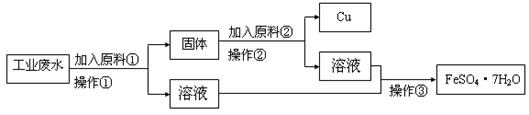
请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。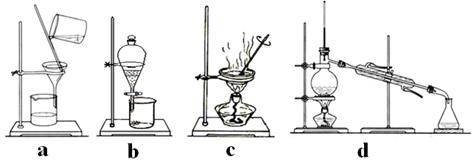
【化学-选修5:有机化学基础】
有机化合物A~H的转换关系如下所示:
请回答下列问题:
(1)A是芳香烃,1 mol A完全燃烧消耗9.5molO2,则A的结构简式是 ,名称是 ;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是 ;
(4)①的反应类型是 ;③的反应类型是 ;
(5)符合下列条件的G同分异构体有 种①遇氯化铁溶液显紫色 ②苯环上有三个取代基③核磁共振氢谱显示苯环上有两种不同环境的氢原子
(6)烃B是E的同分异构体,B分子中的每个碳原子都以单键分别跟其它3个碳原子相连,且B分子中只有一种碳—碳—碳键角,B的结构简式为 。
(Ⅰ)A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题。
(1)已知常温下A为有色气体。若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式_______________________;
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色.则F的化学式为_____________________。
(3)若A为淡黄色固体,则A与水反应的化学方程式为_________________。
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即_______________。C与F反应的化学方程式为________________;
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式_________________________。
(Ⅱ)亚磷酸(H3PO3)是二元弱酸,与足量NaOH溶液反应,生成Na2HPO3。
(1)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01 mol·L-1H3PO3溶液中滴加10mL0.02 mol·L-1NaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________ ;
(2)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的方程式为______.
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
我国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的一种化学合成方法的部分工艺流程如图所示: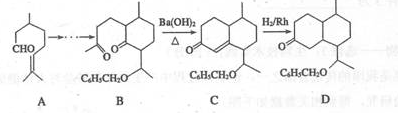

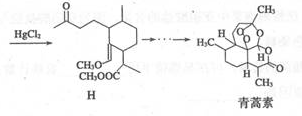
己知:①C6H5-表示苯基;②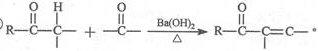
(1)化合物E中含有的含氧官能团有 、 和羰基(写名称)。
(2)1 mol化合物B最多可与_____________molH2发生加成反应。
(3)合成路线中设计E—→F、G-→H的目的是
(4)反应B→C,实际上可看作两步进行,依次发生的反应类型是 、_ __ _ 。
(5)A在Sn-p沸石作用下,可生成同分异构体异蒲勒醇,己知异蒲勒醇分子中有3个手性碳原子(连有四个不同基团的碳原子称为手性碳原子),异蒲勒醇分子内脱水后再与1分子H2发生1,4-加成可生成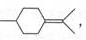 则异蒲勒醇的结构简式为:
则异蒲勒醇的结构简式为:
(6)下图以乙烯为原料制备苄基乙醛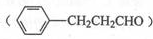 的合成路线流程图。
的合成路线流程图。
请填写下列空白(有机物写结构简式):
物质1为 ;物质2为 ;试剂X为 .条件3为 。
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是_____________(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___ _,1molAB一中含有π键的数目为__ ______(阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及____(填序号)。
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如 其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_ ___ 。金属C的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M g/mol,则表示C原子半径的计算式为 cm(不必化简)。