下图为以惰性电极进行电解:

(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(2)在A、B、C、D各电极上析出生成物的物质的量比为____________________________。
氢氧化镁难溶于水,但它所溶解的那一部分在溶液中完全电离。t ℃时,某饱和氢氧化镁溶液的pH=11,若不考虑KW值的变化,则该温度下的氢氧化镁的溶解度是。
在25 ℃时,有pH为x的盐酸和pH为y的NAOH溶液,取Vx L该盐酸同该NAOH溶液中和,需Vy L NAOH,求:
(1)若x+y=14时,则Vx/Vy=_______________(填数值)。
(2)若x+y=13时,则Vx/Vy=_______________(填数值)。
(3)若x+y>14时,则Vx/Vy=_______________(填表达式),且VxVy____________(填“>”“=”或“<”)。
将4.368 g铁粉完全溶于150 mL 2.0 mol·L-1的稀HCl中,然后通入0.009 mol Cl2,再加入2.94 g重铬酸钾晶体(K2Cr2O7)恰好使溶液中的Fe2+全部转化为Fe3+,重铬酸钾被还原为铬的低价阳离子,已知K2Cr2O7的相对分子质量为294,试求产物中铬元素的化合价。
用氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2====KOCN+2KCl+H2O
被氧化的元素是__________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式,并标出电子转移的方向和数目:
______KOCN+______KOH+______Cl2——______CO2+______N2+______KCl+______H2O
(3)若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯_________g。
已知下列变化中,0.2 mol x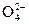 参加反应时共转移0.4 mol电子,
参加反应时共转移0.4 mol电子,
Rx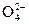 +
+ + H+——RO2+ Mn2++H2O
+ H+——RO2+ Mn2++H2O
(1)求x的值。
(2)求参加反应的H+的物质的量。