X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2 |
某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式是()
| A.C3H8 | B.C4H10 |
| C.C5H12 | D.C6H14 |
用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如图,它属于()
| A.无机物 | B.烃 |
| C.高分子化合物 | D.有机物 |
可逆反应2NO2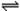 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是()
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是()
①单位时间内生成n molO2的同时生成2n mol NO2
②单位时间内生成n molO2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
短周期中元素a、b、c在周期表中位置如右图,下列有关这三种元素的叙述正确()
| A.a是一种活泼的非金属元素 |
| B.c的最高价氧化物的水化物是一种弱酸 |
| C.b的氢化物很稳定 |
| D.b元素在化合物中的最高价为+7价 |
下列叙述不正确的是()
| A.相同条件下,N2和O2的混合气体与等体积的N2所含原子数相等 |
| B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| C.常温常压下28g CO与22.4 L O2所含分子数相等 |
| D.16 g CH4与18 g NH4+所含电子数相等 |