向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)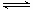 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )
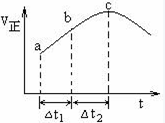
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
现有常温下的四份溶液:①0.01mol/LCH3COOH ②0.01mol/LHCl ③pH=12的氨水④pH=12的 NaOH溶液下列说法正确的是
| A.①中水电离程度最小,③中水电离程度最大 |
| B.将②③混合,若pH=7,则消耗溶液的体积:②﹥③ |
| C.将四份溶液稀释相同倍数后,溶液的pH:③﹥④,②﹥① |
| D.将①、④混合,若有c(CH3COO-)﹥c(H+),则混合液一定呈碱性 |
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2(g)+O2(g) 2SO3(g)△H<0 2SO3(g)△H<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0 4NO(g)+6H2O(g) △H<0 |
C.H2(g)+I2(g) 2HI(g)△H>0 2HI(g)△H>0 |
D.C(s)+H2O(g) CO(g)+H2(g)△H>0 CO(g)+H2(g)△H>0 |
关于反应

 的有关叙述中,正确的是
的有关叙述中,正确的是
A. 中只含有 中只含有 |
B.KCl中只含有 |
C.生成物 的相对分子质量小于71 的相对分子质量小于71 |
D.该反应转移电子数为 |
如下图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
| A.不变 | B.减小 | C.增大 | D.无法确定 |
一定能在下列溶液中大量共存的离子组是
| A.pH=0的溶液:Fe2+、Mg2+、NO3-,SO42- |
| B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- |
| C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- |
| D.pH=14的溶液:Na+、K+、AlO2-、CO32- |