含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于 族,与A同族但相对原子质量比A小的元素B的原子结构示意图为 ,A与B在原子的电子层结构上的相同点是 。
(2)易与C发生化学反应的酸是 ,反应的化学方程式是 。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式: 。
②要将纯碱高温熔化,下列坩埚中可选用的是 。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩锅 D.铁坩锅
(4)100gC与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是 。
(16分)聚乙酸乙烯酪广泛用于制备涂料、粘合剂等,它和高聚物长的合成路线如下: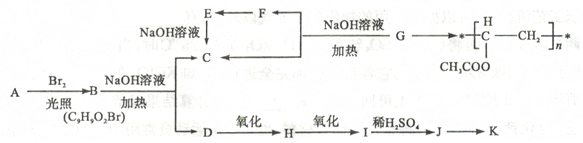
其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物原有两种。
已知①当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
②一ONa连在烃基生不会被氧化
请回答下列问题:CH3COO CH3CH2Br
(1)写出G的结构简式。F与H中具有相同官能团的名称。
(2)上述变化中G→C+F 的反应类型是;J在一定条件下能生成高聚物K,K的结构简式是。
(3)写出B→C+D反应的化学方程式:。
(4)同时符合下列要求的A的同分异构体有种。
I含有苯环
II能发生银镜反应和水解反应
并写出满足下列条件的同分异构体结构简式:。
①核磁共振氢谱有5 个吸收峰
②1mol该同分异构体能与Imol NaOH 反应
(5)下列有关说法正确的是。
a.1 mol A 完全燃烧消耗10.5 mol O2
b.J与足量的碳酸氢钠溶液反应能生成相应的二钠盐
c.D→H 的试剂通常是KMO4酸性溶液
d.J能发生加成、消去、取代、氧化等反应
(14分)X、Y、及W是短周期中的四种元素,其原子序数依次增大。相关信息如下表
| 元素 |
相关信息 |
| X |
具有多种同素异形体,形成的化合物种类繁多 |
| Y |
短周期主族元素中原子半径最大 |
| Z |
位于元素周期表金属与非金属元素的分界线上,最高化合价为十4 |
| W |
富集在海水中的元素,它的某些化合物常用作消毒刹 |
(1)Z元素基态原子的核外电子排布式为,其未成对的电子数目为。
(2)Y位于元素周期表中第周期,第族,四种元素的电负性由大到水的顺序是(写元素符号)。
(3)氢化物中X-H和W-H的化学键极性较强的是,耐磨材料(XY)和单质y 熔点较高的
是(均用元素符号表示)。
(4)已知400 ℃时,HW 可被氧气催化氧化生成W 的单质,从而实现化更生产上W的循环利用。若断开1mo1H一W化学键,该反应放热28.9KJ,试写出相应的热化学方程式:。
在下图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极。
(1)断开K2接通K1时,a为_________极,b电极上的电极反应式为___________________
(2)断开K1接通K2时,a为__________极,该电极上的电极反应式为____________________,一段时间后,溶液的pH_________________(填“增大”,“减小”或“不变”)
【化学一一选修物质结构与性质】
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物, D与B可形成离子化合物其晶胞结构如图所示。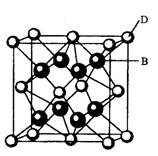
请回答下列问题。
(1)E元素原子基态时的价电子排布式为;
(2)A2F分子中F原子的杂化类型是;
(3)C元素与氧形成的离子CO2-的立体构型是__________;写出一种与CO2-互为等电子体的分子的分子式________;
(4)将E单质的粉末加入CA3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是______________________________________________________;
(5)从图中可以看出,D跟B形成的离子化合物的化学式为;若离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(写出表达式即可)。
选考题【化学一一选修化学与技术】以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下: 
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Zn2+ |
5. 2 |
6. 4 |
| Fe2+ |
5. 8 |
8. 8 |
(1)加入H2O2溶液发生反应的离子方程式为。
(2)流程图中,为了降低溶液的酸度,试剂X不可以是(选填序号:
a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3;d.ZnSO4;pH应调整到;
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为,聚乳酸的结构简式为;
Ⅱ、制取金属锌采用碱溶解ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq),然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为;阴极的电极反应为;
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是。