某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案一: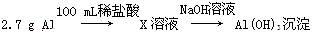
方案二: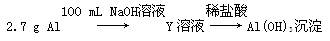
已知:NaOH溶液和稀盐酸的浓度均是3 mol·L-1,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
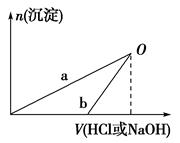
| A.在O点时两方案中所得溶液的溶质物质的量相等 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D.a、b曲线表示的反应都是氧化还原反应 |
溴化碘(IBr)的化学性质与卤素相似,能与大多数金属反应生成金属卤化物,和某些非金属反应生成相应的卤化物,跟水反应的化学方程式为:IBr+H2O====HBr+HIO,则下列关于溴化碘的叙述中不正确的是
| A.固态的溴化碘是分子晶体 |
| B.在许多反应中溴化碘是强氧化剂 |
| C.溴化碘跟水反应时,既是氧化剂,又是还原剂 |
| D.溴化碘与NaOH反应时,生成NaBr、NaIO和H2O |
下图中 4种装置①盛 100mLCuSO4,②盛200mL 0.01mol/ LH2SO4,③盛200mL ZnCl2,④盛200mL NaCl饱和溶液工作一段时间后,测得导线上均通过了0.002 mol电子,此时溶液的 pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)
A.④②③①
B.④③①②
C.④③②①
D.④①③②
</PGN0015B.TXT/PGN>
某学生在做Fe(OH)3胶体凝聚实验时,用①加硅酸胶体,②加Al(OH)3胶体,③加Al2(SO4)3溶液,④加硫化钾胶体,⑤加蒸馏水等5种方法,其中能观察到凝聚现象的是
| A.①②③ |
| B.①③④ |
| C.②④⑤ |
| D.③④⑤ |
把一块锌放在100mL pH值为1的盐酸中,经2min后pH值变为2,则H2产生速度是
| A.0.5 mol/(L·min) |
| B.0.0225 mol/(L·min) |
| C.0.0045mol/(L·min) |
| D.0.00225mol/(L·min) |
R为短周期元素,其原子所具有的电子层数为最外层电子数的
| A.若它能形成①时,则不可能形成②,④ |
| B.若它能形成②时,则还可以形成③,④ |
| C.若它能形成①时,则不可能形成④ |
| D.若它能形成②时,则可以形成① |