向l mL 0.5mol·L-1AlCl3溶液中加入3 mL饱和NaF溶液,再加入l mL 3mol·L-1氨水,没有生成白色沉淀,其最主要的原因是( )
| A.3mol·L-1氨水的浓度不够大,溶液的碱性不够强 |
| B.NaF溶液碱性较强,Al3+完全反应生成AlO2-,而AlO2-不能与氨水反应生成Al(OH)3 |
| C.氨水为弱碱溶液,Al3+不与弱碱反应 |
| D.Al3+与F-结合生成新物质,溶液中几乎没有Al3+ |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72- > I2 |
如图是某“泡腾片”的标签。将这样一粒泡腾片放入水中,药片完全溶解,同时产生大量气泡。这个过程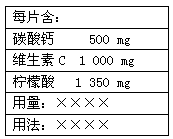
| A.溶解了500 mg的Ca2+ |
| B.释放了224 mL(标准状况)的气体 |
C.发生了反应: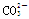 +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| D.说明了柠檬酸的酸性比碳酸强 泡腾片 |
有一种军用烟幕弹中装有ZnO、Al粉和C2Cl6,其发烟过程中的化学反应如下:
① 3ZnO+2Al=Al2O3+3Zn;② 3Zn+C2Cl6=3ZnCl2+2C。下列有关叙述不正确的是
A.反应①是铝热反应
B.反应②是置换反应
C.C2Cl6属于有机物
D.烟幕是小液滴分散在空气中形成的
I2Cl6晶体在常温下就会“升华”,蒸气冷却可得到晶体ICl3。ICl3遇水会产生大量的腐蚀性白色烟雾,有强烈的催泪性。若生成物之一是HCl,则另一种是
| A.HIO3 | B.HIO2 | C.HIO | D.ICl |
Na2CO3、CaCO3、BaCO3、CuCO3等碳酸盐都能与相同浓度的稀硫酸反应放出CO2,其中反应最为缓慢的是
| A.BaCO3 | B.CuCO3 | C.Na2CO3 | D.CaCO3 |