将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是( )
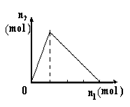
| |
A |
B |
C |
D |
| X |
NaOH |
AlCl3 |
HCl |
NaAlO2 |
| Y |
AlCl3 |
NaOH |
NaAlO2 |
HCl |
已知X、Y均为1—18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则这两种元素的原子序数之和为
| A.19 | B.18 | C.16 | D.9 |
在短周期元素中,原子最外电子层只有1个或2个电子的元素是
| A.金属元素 | B.稀有气体 | C.非金属元素 | D.无法确定为哪一类元素 |
常温下,分别将四块形状相同且质量均为7g的铁块同时投入下列四种溶液中,产生气体的速率最快的是
| A.1000mL2mol/LHCl | B.500mL4mol/L H2SO4 |
| C.50ml3mol/LHCl | D.50mL18.4mol/L H2SO4 |
下列说法中正确的是
| A.甲烷分子中只含有非极性键 |
| B.乙烯只能加成、不能取代,苯只能取代、不能加成 |
| C.常温下,苯是一种不溶于水且密度比水小的液体 |
| D.CH3COOH和CH3CH2OH互为同系物 |
A、B、C为三种短周期元素,只有A、B在同一周期,A、C的最低价离子分别为A2-、C--,离子半径A2-大于C-,B2+和C-具有相同的电子层结构。下列判断正确的是
A.原子序数由大到小的顺序是C>A>B
B.原子半径由大到小的顺序是B>A>C
C.离子半径由大到小的顺序是C->B2+>A2-
D.原子最外层电子数由多到少的顺序是B>A>C