常温下,在溶液中可发生以下反应:
①2Fe2++Br2===2Fe3++2Br-;②2Br-+Cl2===Br2+2Cl-;③2Fe3++2I-===2Fe2++I2。
由此判断下列说法错误的是( )
| A.I-和Cl2不能够发生氧化还原反应 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2>Br2>Fe3+>I2 |
| D.还原性强弱顺序为:I->Fe2+>Br->Cl- |
某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl)︰n(H2SO4)=3︰1。若以石墨电极电解该溶液,下列推断中不正确的是 ( )
| A.阴极产物为H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解液的pH不断增大,最终大于7 | D.整个电解的过程实质是电解水 |
图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通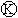 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )
| A.a为直流电源的负极 | B.d极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 | D.e极发生氧化反应 |
报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2 + 4OH—  2CO32— + 6H2O,则下列说法错误的是 ( )
2CO32— + 6H2O,则下列说法错误的是 ( )
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
| A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 |
| B.电池负极反应式为:O2 + 2H2O + 4e—= 4OH— |
| C.电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D.电池中c(KOH)不变;电解池中溶液pH变大 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl- +2e-=Cl2↑ |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- ="=" 4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- ="=" Cu2+ |
| D.钢铁发生电化学腐蚀的负极反应式:Fe-2e- ="=" Fe2+ |