CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法正确的是( )
| A.途径①和途径②都体现了硫酸的酸性和氧化性 |
| B.Y可以是酒精溶液 |
| C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D.将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 |
已知下列四个热化学方程式: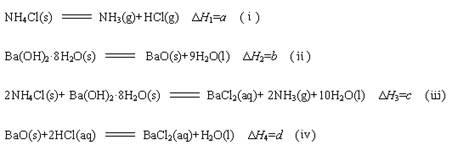
其中a、b、c 均大于0,HCl气体溶解于水,溶液温度升高。由此可知下列判断一定正确的是
| A.d<0 | B.c<2a+b-d | C.c=2a+b+d | D.c>2a+b-d |
科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900 ℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是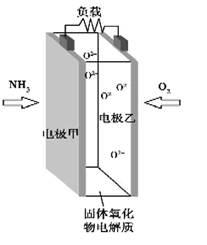
| A.电极甲为电池正极 |
| B.电池总反应为4NH3+5O2=4NO+6H2O |
| C.电池正极反应式为O2+2H2O+4e-=4OH- |
| D.图示中的O2-由电极乙移向电极甲 |
X、Y、Z、W 均为主族元素,其原子序数依次增大,且原子序数均小于或等于20。X、Z 处于同一主族,Y、Z 处于同一周期,X 为地壳中含量最多的元素,Y、W 在化合物中均只有一种化合价,分别为+1 和+2。下列说法正确的是
| A.原子半径:Z>Y>X |
| B.X、Y 形成的化合物均为离子化合物,其结构中只有离子键 |
| C.最外层电子数:X=Z>W>Y |
| D.最高正化合价:X=Z>W>Y |
金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法正确的是
| A.金合欢醇与乙醇是同系物 |
| B.金合欢醇可发生加成反应,但不能发生取代反应 |
| C.1 mol 金合欢醇能与3 mol H2反应,也能与3 mol Br2 反应 |
| D.1 mol 金合欢醇与足量Na 反应生成0.5 mol 氢气,与足量NaHCO3溶液反应生成1molCO2 |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.2.8 g 一氧化碳和乙烯的混合气体中所含的碳原子数目为0.1NA |
| B.标准状况下5.6 L N2O 气体所含的电子数为5.5NA |
| C.用惰性电极电解CuCl2溶液阴极得到0.1NA个Cu 原子时,阳极生成2.24 L 气体 |
| D.0.1 mol·L-1的NaCl 溶液中,Na+与Cl-的总数目为0.2NA |