把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
| A.HCO3- | B.Cl- | C.Mg2+ | D.Na+ |
| A.将块状碳酸钙固体换成粉末状固体 | B.盐酸的量增加一倍 |
| C.盐酸的用量减半浓度加倍 | D.温度升高40 0C |

其中, (W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是()
(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是()
| A.图I可能是不同压强对反应的影响,且P2>P1,a+b<n |
B.图III可能是不同温度对反应的影响,且T1>T2,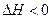 |
| C.图II可能是不同压强对反应的影响,且P1>P2,n<a+b |
| D.图II可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好 |
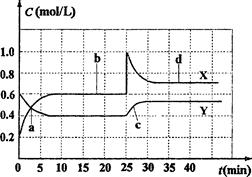
| A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4molN2O4 |
| D.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积 |
|
| A.烧瓶内气体的颜色不变,不再加深 |
B.NO2的物质的量浓度不变 |
| C.N2O4的消耗速率与NO2的生成速率之比为1:2 | |
| D.NO2的生成速率与NO2的消耗速率相等 |

A.起始反应时,甲容器的正反应速率与乙反应的正反应速率相同
B.均达到平衡后,反应速率乙容器是甲容器的2倍
C.均达到平衡后,混合气体的平均相对分子质量乙容器是甲容器的2倍
D.均达到平衡后,再向乙容器加2molA、2molB,达到新的平衡后,C的体积分数乙容器大于甲容器