丙烯醛的结构简式为CH2=CHCHO,下列有关其性质的叙述中不正确的是
| A.能使溴水褪色 | B.能与过量的氢气充分反应生成丙醛 |
| C.不能发生银镜反应 | D.能被新制的氢氧化铜氧化 |
下列有机物命名正确的是
| A.CH2Br-CH2Br 二溴乙烷 |
B.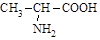 丙氨酸 丙氨酸 |
C.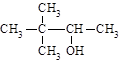 2,2-二甲基-3-丁醇 2,2-二甲基-3-丁醇 |
D.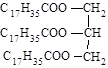 硬脂酸甘油脂 硬脂酸甘油脂 |
下列有关化学用语的使用正确的是
A.二氧化碳的电子式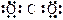 |
B.铝的原子结构示意图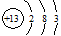 |
| C.甲醛的结构式HCHO | D.氧原子的轨道表示式 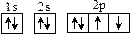 |
将CO2转化成有机物,可有效实现碳循环。CO2转化成有机物的例子很多,以下反应中,最节能的是
A.6CO2 + 6H2O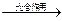 C6H12O6 C6H12O6 |
B.CO2 + 3H2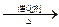 CH3OH +H2O CH3OH +H2O |
C.CO2 + CH4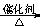 CH3COOH CH3COOH |
D.2CO2 + 6H2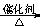 CH2=CH2 + 4H2O CH2=CH2 + 4H2O |
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
| A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B.若金属全部溶解,则溶液中一定含有Fe3+ |
| C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3 |
| D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。
下列说法中正确是

| A.在一定条件下,当 v(正)A :v(逆)C=1:2时的状态即为化学平衡状态 |
| B.20min时A的反应速率为0.05mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.30min时降低温度,40min时升高温度 |