某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
| A.该溶液可能由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;② CO和CO2都是酸性氧化物;③蔗糖、硫酸钡分别属于非电解质和电解质;④CuO和Fe2O3都是碱性氧化物;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦NaCl和KCl可用焰色反应鉴别。上述说法正确的是
| A.①②③④ | B.①③④⑦ | C.③⑤⑥⑦ | D.①②⑤⑥ |
下列离子方程式书写正确的是
| A.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓ |
C.三氯化铁溶液中加入铜粉: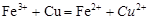 |
| D.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑ |
“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是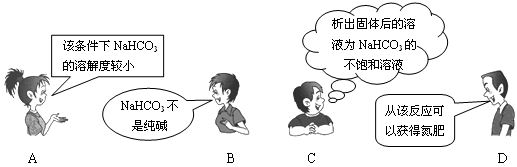
以下实验装置一般不用于分离物质的是 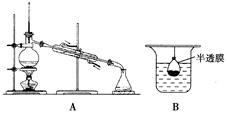
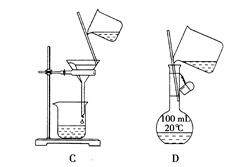
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ: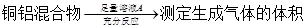
方案Ⅱ: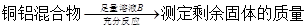
下列有关判断中不正确的是
| A.溶液A和B均可以是盐酸或NaOH溶液 |
| B.溶液A和B均可以选用稀硝酸 |
| C.若溶液B选用浓硝酸,则测得铜的质量分数偏小 |
| D.实验室方案II更便于实施 |