下列关于反应速率的说法中,错误的是
| A.反应速率可衡量化学反应的快慢 |
| B.决定反应速率的主要因素是反应物的性质 |
| C.可逆反应达到化学平衡时,正、逆反应速率都为0 |
| D.增大反应物浓度、提高反应物温度都能增大反应速率 |
下列说法不正确的是
| A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 |
| B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 |
| C.铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.HNO3→NO→NO2,以上各步变化均能通过一步实现 |
下列选项中物质的转化在一定条件下不能实现的是
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl—→2KCl+5Cl2↑+2MnCl2+8H2O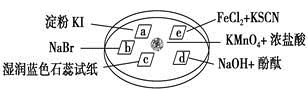
对实验现象的“解释或结论”正确的是
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+>Cl- |
下列化学实验事实及其结论都正确的是。
| 选项 |
实验事实 |
结论 |
| A |
将SO2通入含HClO的溶液中生成H2SO4 |
HClO的酸性比H2SO4强 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔表面氧化铝熔点高于铝 |
| C |
SiO2可以和NaOH溶液及HF溶液反应 |
SiO2属于两性氧化性 |
| D |
将SO2通入溴水中,酸性高锰酸钾溶液褪色 |
SO2具有漂白性 |
下列有关物质应用的说法中,正确的是
| A.用石英器皿盛装氢氟酸 |
| B.臭氧具有强还原性,可用于自来水的杀菌消毒 |
| C.Fe3+具有氧化性,可腐蚀印刷线路板上的铜 |
| D.硫酸钡俗称“钡餐”,可用于治疗胃酸过多 |