从海水中可以获得淡水、食盐,也可提取镁和溴等物质。
(1)海水淡化的方法主要有______ (填一种)。
(2)从海水中提取镁的流程如下图所示: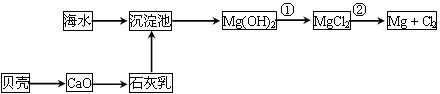
流程中分离Mg(OH)2沉淀的方法是_____________________;
写出反应②的化学方程式____________________________。
(3)从海水中提取溴的主要反应原理是向浓缩的海水中通入氯气,将溴离子氧化。试写出该反应的离子方程式________________________________________________。
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是。(填字母)
| A.向平衡混合物中充入Ar | B.向平衡混合物中充入O2 |
| C.改变反应的催化剂 | D.降低反应的温度 |
(4)反应:2SO2(g)+O2(g) 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。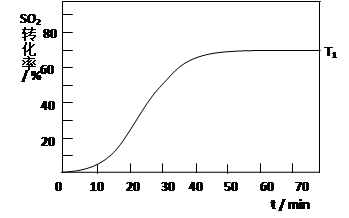
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、 Fe2+、 Al3+,阴离子有Cl-、 OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。请根据上述实验现象,写出下列六种化合物的化学式:
A,B________,C,D,E,F。
物质X、Y、Z均含同种短周期元素,其转化关系如下图所示(反应条件未标出)。
(1)若X是无色极易溶于水的刺激性气味气体,Z是红棕色气体,由Y与W反应生成Z的化学方程式是_______________________________________________________。
(2)若X含三种短周期元素,其中两种元素的原子的质子数之和等于另一种元素原子的质子数,单质W是常见金属,则X的稀溶液转化为Y的离子方程式是
。
(3)若X是空气的主要成分之一,W原子的最外层电子数是内层电子数的二倍;则Y与W反应生成0.1 mol Z时,反应中转移的电子数为__________________________。
(4)若Y是白色胶状沉淀,W为烧碱,则0.1mol Y与足量W反应生成Z时消耗烧碱的质量为克 。
X、Y、Z、M、G五种元素分属三个不同短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。Y2是空气的主要成分之一。请回答下列问题:
(1)M在元素周期表中的位置为________________。
(2)Y、Z的单质或两元素之间形成的化合物共有________种;Y、G的单质或两元素之间形成的化合物可作水消毒剂的有(写出两种物质的化学式)
(3)上述五种元素中两元素形成的化合物之间可相互反应生成单质M的化学方程式为
。
(4)ZX与水反应放出气体的化学方程式为___________________________。
当三份铜粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸充分反应后,收集到的气体在相同状况下体积相等时(不考虑NO2转化为N2O4 、生成气体溶解及产生水蒸气的体积),其三份铜的质量比为
(2)1.28克铜与适量的浓硝酸反应,铜完全溶解,共收集到672 ml NO、NO2混合气(标准状况),则反应中共消耗HNO3的物质的量为
(3)用20ml 18.4 mol/L浓硫酸和铜共热一段时间后,冷却、过滤,将滤液稀释到100ml,测得溶液中SO42— 的浓度为3.18mol/L,则该溶液CuSO4的物质的量浓度为
(4)Na2SiO3可以改写成氧化物的形式为Na2O·SiO2,则质量分数为98%的浓硫酸改写成氧化物的形式为。