在密闭容器中进行如下反应:X2(g)+Y2(g)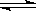 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.3mol/L | B.Y2为0.4mol/L |
| C.X2为0.2mol/L | D.Z为0.4mol/L |
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是 ( )
| A.实验结束时,装置(1)左侧的液面一定会下降 |
B.实验 结束时,装置(1)左侧的液面一定比装置(2)的低 结束时,装置(1)左侧的液面一定比装置(2)的低 |
| C.实验结束时,铁钉b腐蚀最严重 |
| D.实验结束时,铁钉c几乎没有被腐蚀 |
已知:(1)H2(g)+1/2O2(g)===H2O(g) ΔH1=a kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ/mol
(3)H2(g)+1/2O2(g)===H2O(l) ΔH3=c kJ/mol
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ/mol下列关系式中正确的是 :
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
下列说法正确的是( )
| A.含有共价键的化合物一定是共价化合物 | B.共价化合物中只含共价键 |
| C.由共价键形成的分子一定是共价化合物 | D.只有非金属原子间才能形成共价键 |
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
| A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 |
| B.元素X不能与元素Y形成化合物X2Y2 |
| C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
| D.元素W、R的最高价氧化物的水化物都是强酸 |
砷为第4周期VA族元素,根据它在周期表中的位置推测,砷不可能具有的性质是( )
| A.砷在通常状况下是固体 | B.可以有-3、+3、+5等多种化合价 |
| C.As2O5对应水化物酸性比H3PO4弱 | D.砷的还原性比磷弱 |