尼泊金酯是国际上公认的广谱性高效防腐剂,被广泛应用于食品、医药和化妆品的防腐等领域。某尼泊金酯W在酸性条件下水解,可生成分子式为C7H6O3的有机物A和分子式为C3H8O的醇B。A的红外光谱表征到了羧基、羟基和苯环的存在,核磁共振氢谱表明其有4种不同化学环境的氢原子,且峰面积比为1∶2∶2∶1。
(1)W的分子式为 。
(2)B的结构简式可能为 、 。为确定B的结构,可采用下列方法中的 (填序号)。
a.检验能否与金属Na反应生成H2
b.核磁共振氢谱法
c.检验被氧气催化氧化的产物能否发生银镜反应
(3)写出A与足量NaOH溶液反应的化学方程式 。
(4)写出同时满足下列条件的W的一种同分异构体结构简式 。
a.分子中不含甲基且苯环上有两个对位取代基
b.属于酯类
c.遇FeCl3溶液显紫色
N3-称为叠氮离子,1个N3-中共含有个电子,与N3-离子有相同电子数和原子数的分子有(写出2种)。
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中Q所处的周期序数是其主族序数的一半,请回答下列问题:
⑴T的最高价氧化物对应的水化物为_____________。
⑵原子的得电子能力:Q______W(填“强于”或“弱于”)。
⑶原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________。
⑷W的单质与其最高价氧化物对应的水化物的浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_______________。
已知四种短周期元素形成的离子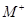 、
、 、
、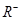 、
、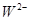 具有相同的电子层结构。(用推断出的元素符号表示)
具有相同的电子层结构。(用推断出的元素符号表示)
①M、N、R、W的原子序数由大到小的顺序是。
②M、N、R、W的原子半径由大到小的顺序是。
③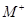 、
、 、
、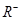 、
、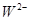 的离子半径由大到小的顺序是 。
的离子半径由大到小的顺序是 。
0.5mol 的Y元素的离子得到6.02×1023个电子被还原成中性原子,0.4gY的氧化物恰好与100ml 0.2mol .L-1 的盐酸完全反应,Y原子核内质子数和中子数相等。写出:
(1)Y的名称为,它在周期表的位置为
(2)Y的氧化物与盐酸反应的离子方程式为。
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则B为(填元素符号)____________,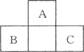
画出A的离子结构示意图: ______________,
C的最高价氧化物的分子式:__________________
用电子式表示A的氢化物分子的形成过程: